Amsterdams-Amerikaans experiment wijst op bestaan van twee soorten sterk onderkoeld water
Bijzonder antivriesmiddel houdt water ook bij extreme afkoeling vloeibaar
8 maart 2018
Water gedraagt zich totaal anders dan de meeste andere vloeistoffen. Die krimpen bijvoorbeeld als je ze afkoelt, terwijl water beneden 4 graden juist uitzet. Ook voor wat betreft de soortelijke warmte en de samendrukbaarheid vertoont water bij afkoeling onverwacht gedrag. Onder de nul graden nemen de afwijkingen van het normale gedrag zelfs dramatische vormen aan.
Je zou misschien denken: water bevriest toch bij nul graden, maar dat is niet altijd het geval. Om te kunnen bevriezen, moeten watermoleculen ergens een beginnetje van een ijskristal maken. In superschoon water gaat dat heel moeilijk, en dat bevriest daarom pas rond de min 40 graden (het smelt altijd bij nul graden). Water dat bij temperaturen onder het vriespunt nog vloeibaar is, wordt onderkoeld water genoemd. Er zijn volop YouTube-filmpjes die laten zien hoe je onderkoeld water thuis zelf kunt maken en hoe je er proefjes mee kunt doen.
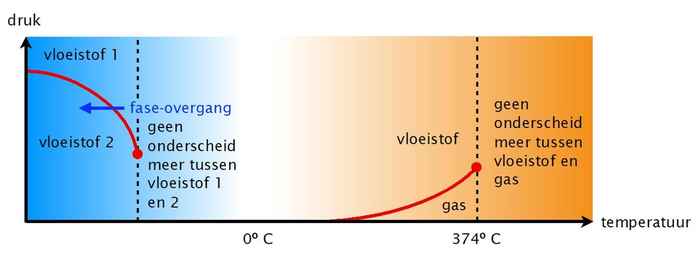
Twee vloeibare toestanden
In 1992 suggereerden theoretisch natuurkundigen van Boston University (Verenigde Staten) dat de vreemde eigenschappen van water gerelateerd zouden kunnen zijn aan het bestaan van twee verschillende toestanden (een compacte en minder compacte) van onderkoeld water bij zeer lage temperatuur en hoge druk. We weten dat er bij gewone temperaturen maar één soort water is; volgens de theorie verdwijnt het onderscheid tussen de twee soorten onderkoeld water dan ook boven een bepaalde temperatuur die ver onder de nul graden ligt. Het verdwijnen van het onderscheid tussen de twee verschillende vloeistoftoestanden boven deze temperatuur (het zogenaamd kritische punt) zou volgens de theorie de bijzondere eigenschappen van water bij hogere temperaturen verklaren.
Het zal niemand verbazen dat sommige onderzoekers twijfels hadden bij dit idee. Op school leren we immers dat stoffen in drie verschijningsvormen voorkomen: vast (moleculen gestapeld in een regelmatig patroon), vloeibaar (moleculen bewegen wanordelijk door elkaar), en gasvormig (geïsoleerde moleculen bewegen onafhankelijk van elkaar). Met het voorkomen van twee vloeibare toestanden zou water een uitzondering zijn.
De afgelopen jaren hebben computersimulaties en experimenten dit vermoeden versterkt, maar het bleef moeilijk om de twee theoretisch voorspelde vloeibare toestanden ook echt experimenteel waar te nemen. Dat lijkt op het eerste gezicht ook zo goed als onmogelijk: de voorspelde temperatuur waarbij de ene toestand verandert in de andere ligt namelijk ver onder de min 40 graden. Water zal dus altijd bevriezen (vast worden) voordat je de tweede vloeibare verschijningsvorm kunt zien.
Antivries en infrarood
Door een bijzonder soort antivries te gebruiken zijn de onderzoekers van UvA en ASU er nu toch in geslaagd om een toestandsverandering in vloeibaar water waar te nemen bij de extreem lage temperatuur van ongeveer 80 graden onder nul. De experimenten werden gedaan door Michiel Hilbers, Sander Woutersen (UvA), Zuo-Feng Zhao en Austen Angell (ASU). Om de verandering in vloeistofstructuur vast te stellen, maten Hilbers en Woutersen met infrarood licht de trillingen van de OH-bindingen van watermoleculen. De frequentie van die trillingen is namelijk sterk afhankelijk van de lokale vloeistofstructuur.Aanvankelijk gebruikten de Amsterdammers glycerol als antivries. Dat mengt in principe goed met water en voorkomt zo dat watermoleculen ijskristallen kunnen vormen. Helaas bleek het bij zeer lage temperatuur, net op het moment dat de tweede vloeistoffase zou verschijnen, niet meer goed te werken: dan mengen water en glycerol niet meer goed en verandert de vloeistof in een slush puppie van ijskristalletjes in glycerol. Daarmee leek het onderzoek te zijn gestrand.
Bezoek aan Amsterdam
De doorbraak kwam toen Woutersen in gesprek raakte met de Amerikaan Austen Angell, die aan de Arizona State University al heel lang aan onderkoeld water werkt. Angell, die in 1971 een sabbatical aan de UvA had gedaan, kwam in de zomervakantie van 2016 een middagje op bezoek op uitnodiging van Daniel Bonn, hoofd van het Van der Waals-Zeeman Instituut van de UvA. Angell suggereerde om een speciaal soort antivries te gebruiken, hydrazinium trifluoracetaat, dat zeer goed mengt met water maar geen noemenswaardige invloed heeft op de waterstructuur, zoals zijn postdoc Zuo-Feng Zhao experimenteel kon aantonen. Computersimulaties van Woutersens collega Bernd Ensing toonden aan dat deze antivriesmoleculen perfect passen in het netwerk van waterstofbruggen in vloeibaar water, en daardoor zelfs bij zeer lage temperaturen het bevriezen van water voorkomen.
Structuurverandering waargenomen
Daarmee werd het lage-temperatuurgebied eindelijk toegankelijk. En zowaar: tijdens het afkoelen zagen de onderzoekers bij een temperatuur van ongeveer min 80 graden een scherpe verandering in de vloeistofstructuur. En wanneer de vloeistof weer werd opgewarmd, veranderde bij diezelfde temperatuur de vloeistofstructuur weer terug. Daarmee lijkt de twee-vloeistof-hypothese voor onderkoeld water, na meer dan 25 jaar, eindelijk experimenteel bevestigd. ‘Lijkt!’, benadrukt Woutersen, ‘want let wel: dit is water met een flinke scheut antivries erin. Weliswaar antivries die de structuur minimaal verstoort, maar toch. En ik kan niet genoeg benadrukken: bij normale temperaturen, óók onder nul, is er maar één soort water!’
Publicatiegegevens
Sander Woutersen, Michiel Hilbers, Bernd Ensing, Zhaofeng Zhao & Austen Angell: ‘A liquid-liquid transition in supercooled aqueous solution related to the HDA-LDA transition’, in: Science 09 Mar 2018, Vol 359, Issue 6380 pp. 1127. DOI:10.1126/science.aao7049